अणुगति सिद्धांत || गैलूसाक, बाँयल और चार्ल्स का नियम || आदर्श गैस || हिंदी में
पदार्थ का अणुगति सिद्धांत :

" वे सभी चीजें जो स्थान घेरती है तथा द्रव्यमान रखती है, पदार्थ कहलाती है।"
पदार्थ के अणुगति सिद्धांत के अनुसार,
सभी पदार्थ बहुत छोटे-छोटे कणों से मिलकर बना होता है। ये अणु अथवा परमाणु अपने बीच कुछ रिक्त स्थान रखते है । तथा उस रिक्त स्थान में निरंतर गति करते रहतें है। पदार्थ के अणुओं यह गति अनियमित होती है अर्थात अणुओं की गति के दौरान उनकी चाल व दिशा बदलती रहती है । पदार्थ के अणुगति सिद्धांत की मदद से पदार्थेां के बीच उष्मा ,दाब , ताप ,आयतन आदि के आधार पर संबंध स्थापित किया जाता है। पदार्थ का अणुगति सिद्धांत पदार्थ के व्यवहार को समझने सहायता करता है।
पदार्थ के अणुगति सिद्धांत के अनुसार,
सभी पदार्थ बहुत छोटे-छोटे कणों से मिलकर बना होता है। ये अणु अथवा परमाणु अपने बीच कुछ रिक्त स्थान रखते है । तथा उस रिक्त स्थान में निरंतर गति करते रहतें है। पदार्थ के अणुओं यह गति अनियमित होती है अर्थात अणुओं की गति के दौरान उनकी चाल व दिशा बदलती रहती है । पदार्थ के अणुगति सिद्धांत की मदद से पदार्थेां के बीच उष्मा ,दाब , ताप ,आयतन आदि के आधार पर संबंध स्थापित किया जाता है। पदार्थ का अणुगति सिद्धांत पदार्थ के व्यवहार को समझने सहायता करता है।
अणुगति सिद्धांत की कुछ अवधारणायें
1. प्रत्येक पदार्थ बहुत ही सूक्ष्म कणों से मिलकर बनता है जिन्हे अणु कहा जाता है।
3. पदार्थ के अणु सभी संभव दिशाओं में निरंतर गति करते रहते है अणुओं की इस गति के आधार पर ही उनके भोतिक स्वरूप (ठोस ,द्रव अथवा गैस) का निर्धारण होता है ।गैसों के अणुओ के बीच मौजूद रिक्त स्थान ठोस अथवा द्रव के अणुओं कें बीच उपस्थित रिक्त स्थान की तुलना में अधिक होता है तथा गैस के अणुओं की गतिज उर्जा भी ठोस अथवा द्रव के अणुओं से अधिक होती है ।जिसके कारण गैस का कोई निश्चित आकार तथा आयतन नही होता है । इसी प्रकार द्रव के अणुओ के बीच रिक्त स्थान ओर अणुओं की गतिज उर्जा का मान ठोस से अधिक किन्तु गैस के अणुओ की तुलना में कम होता है जिससे द्रव का आयतन तो निश्चित होता है किन्तु द्रवो का आकार निश्चित नही होता है इसलिये बे जिस पात्र में डाले जाते है उसी का आकार ग्रहण कर लेते है।जबकि ठोसो के बीच मौजूद रिक्त स्थान व उनकी गतिज उर्जा के कारण उनका आकार ओर आयतन दोनों ही निश्चित होता है।
4. पदार्थ के अणुओ के बीच एक बल कार्य करता है जिसे अन्तराण्विक बल कहते है।तथा इस बल की प्रक्रति विद्युतीय होती है।
5. किन्ही दो अणुओं के बीच होने बाली टक्कर पूर्णत: प्रत्यास्थ तथा क्षणिक होती है ।टक्कर के बाद अणुओं के बीच कोई आकर्षण या प्रतिकर्षण बल कार्य नही करता है।
बॉयल का नियम
सन 1660 में अग्रेंज वैज्ञानिक राबर्ट बायल गैस के ताप , दाब तथा आयतन के बीच होने बाले परिवर्तन का विस्तार से अध्ययन किया और नियम प्रतिपादित किया जिसे बॉयल का नियम कहते है।
इसके अनुसार,’’ स्थिर ताप पर किसी गैस के निश्चित द्रव्यमान का आयतन उसके दाब के व्युत्क्रमानुपाती होता है’’
यदि हम स्थिर ताप को T निश्चित द्रव्यमान का दाब P और आयतन को V मानें तब बॉयल के नियमानुसार ,
V∝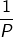
V=K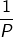
PV= K
यहॉं K एक स्थिरांक है। अर्थात स्थिर ताप पर किसी गैस के निश्चित गैस के निश्चित द्रव्यमान के दाब और आयतन का गुणफल एक नियतांक के बराबर होता है।
जब हम अलग अलग गैस के अलग –अलग आयतन ले तो
P1V1=P2V2=P3V3=K
निम्न दाब ओर उच्च ताप पर सभी गैसें बॉयल के नियम का पालन करती है ।
चार्ल्स का नियम
सन 1877 में फ्रासिंस वैज्ञानिक जे चार्ल्स ने स्थिर दाब पर गैसों का आयतन परमताप के बीच संबध के आधार पर नियम प्रतिपादित किया जिसे चार्ल्स का नियम कहते है।
इस नियम के अनुसार ,
“स्थिर दाब पर किसी गैस के निश्च्ति द्रव्यमान का आयतन उसके परम ताप के अनुत्क्रमानुपाती होता है।
यदि स्थिर दाब P पर किसी गैस के निश्चित द्रव्यमान का आयतन V व परम ताप T हो तो चार्ल्स के नियम से ,
V∝T
V=KT
निश्चित द्रव्यमान की गैस का स्थिर दाब पर आयतन और परमताप का अनुपात स्थिरांक होता है ।
V1,V2,V3 अलग-अलग गैस के आयतन है
T1,T2,T3 गैसो के अलग-अलग तापमान
K स्थिरांक
वैज्ञानिक चार्ल्स ने स्थिर दाब पर किसी गैस की निश्चित मात्रा के ताप में परिवर्तन करने पर आयतन में परिवर्तन के लिये एक और संबंध स्थापित किया जो इस प्रकार है
‘स्थिर दाब पर किसी गैस की निश्चित मात्रा के ताप को 1 डिग्री सेल्सियस बढाने पर उसका आयतन 0 डिग्री सेल्सियस वाले आयतन का 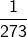 वॉं भाग बढ जाता है’
वॉं भाग बढ जाता है’
यहॉ
Vt = t डिग्री सेल्सियस पर गैस का आयतन
Vo=0 डिग्री सेल्सियस पर गैस का आयतन
t=ताप में परिवर्तन
यदि गैस का ताप -273 °C कर दिया जाये तो गैस का आयतन शून्य हो जायेगा। अत: इस तापमान को परमशून्य ताप कहते है जिसकी एस आई पद्धिति मे इकाई केल्विन होती है।
Read more.
- Newton's 1st Law of Motion
- Newton's 2nd Law of Motion
- Newton's 3rd Law of Motion
- Fleming's Right Hand Rule in Hindi
- Joule's Law and its Formula in Hindi
- Electric Current, Coulom's law and Ohms's law in Hindi





0 Comments
Comment Related Post
Emoji